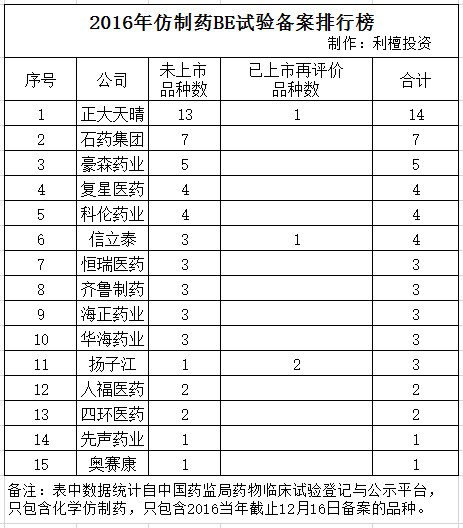
解释一下:
(1)BE试验中文叫做生物等效性试验,是仿制药申报生产前必须做的试验,也是一致性评价的关键指标,如果这个试验的指标显示仿制药和原研药非常类似,就可以认为通过一致性评价,报生产获批的概率比较高。
(2)BE试验数从2016年开始的3年左右是比较重要的观察指标,一方面因为要对已经上市的仿制药进行一致性评价,时间紧急,资源紧张,花费巨大,另一方面,自2015年下半年起,临床申报批量审评,多家公司几乎是一起拿到仿制药临床批件,4类仿制药BE试验只需要备案,那就得抢了,BE试验成了抢跑的观察指标。
(3)2016年只是热身,药企们大多在做生物等效试验的前期工作,2017年才是真正拼抢的一年,临床试验资源很紧张,得排队,2018年是2007年之前上市仿制药的一致性评价大限,时间紧迫,许多仿制药只做一次BE试验还通不过,可能需要做多次。
(4)在2017年已上市药品一致性评价抢BE试验资源的情况下,这几年原研过期品种也不少,首仿也需要抢临床试验资源,那就要拼研发实力、研发速度和资金实力了。
这几年,药企在仿制药领域重点就做一件事:打砸抢,打实研发能力、砸钱做试验、抢跑首仿和一致性评价。
另外,这张表只是2016年的数据,说明的问题有限,一些公司重点不再仿制药上,比如恒瑞医药,有一堆Me too新药做临床,主要精力在创新药上。
