新浪博客
T)是一种辅助生殖技术,旨在筛选无(家族性)遗传变异的胚胎,特别适用于有较高遗传风险的夫妇,例如携带单基因疾病或结构性染色体重排的个体。选择未受影响的胚胎需借助体外受精(IVF)技术,包括胞浆内精子注射(ICSI),随后对胚胎细胞进行基因检测。
PGT 过程对女性身体和夫妇心理均带来显著负担,同时该程序成本高昂,且整个流程可能需耗时数月。即便如此,并非所有 PGT 受试者都能成功怀孕并顺利生育健康婴儿,成功率约为 50%–60%。因此,夫妇在接受 PGT 之前,需充分了解该程序的费用、成功率、周期持续时间以及 IVF 过程,并接受必要的咨询服务。
准确表征家族中的致病变异及其临床表型,对评估遗传变异的因果关系、疾病严重程度,以及筛选真正高风险的夫妇至关重要。不应对渗透率低或表达模式可变的遗传变异进行不必要的 PGT,以避免年轻夫妇经历长期的医疗过程、额外的负担和经济压力,特别是当 PGT 对其子代风险降低幅度较小或不确定时。
基于临床和遗传变量的客观决策模型,可帮助临床医生在与患者讨论 PGT 预期降低的风险时提供科学依据,从而改善 PGT 的可及性。美国(美国心脏病学会 [ACC]、美国心脏协会 [AHA])及欧洲(欧洲心脏病学会 [ESC]、欧洲心律协会 [EHRA])的最新指南已将 PGT 作为育龄期单基因遗传性心脏病患者的可选方案,并承认目前尚缺乏专门针对心脏遗传适应症的 PGT 指南。
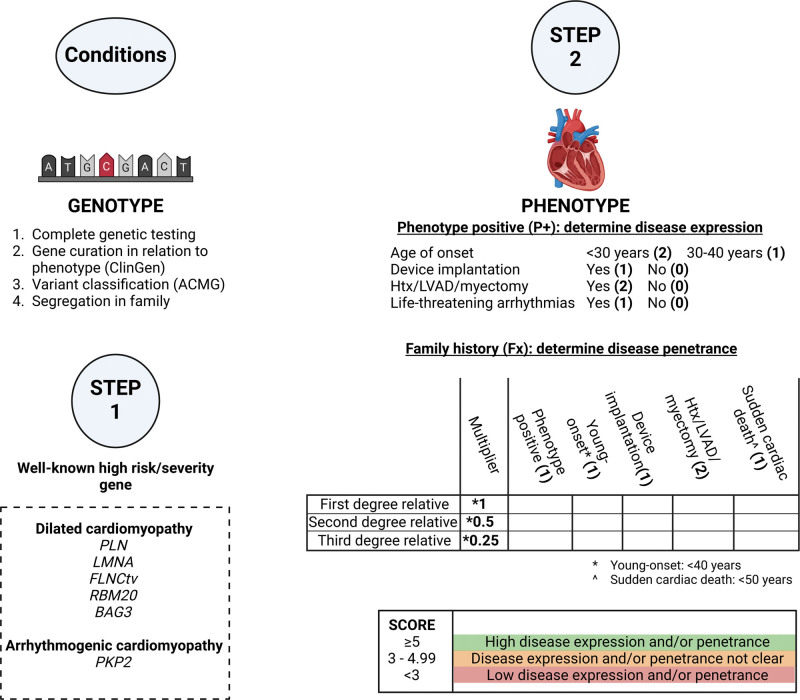
图 1:两步决策模型用于评估遗传性心脏病的植入前基因检测 (PGT) 转诊。有关条件和 2 个步骤的详细描述,请参阅方法部分。步骤 2 中临床参数后面的粗体数字表示可得的分数(参见图4中的 2 个模型应用示例)。一级亲属(50% 共享 DNA)是个人的父母、同胞兄弟姐妹或孩子。二级亲属(25% 共享 DNA)是叔叔、阿姨、侄子、侄女、祖父母、孙子女、同父异母兄弟姐妹和表兄弟姐妹。三级亲属(12.5% 共享 DNA)包括曾祖父母、曾孙子女、叔祖父、姑祖母、堂兄弟姐妹、同父异母叔叔、同父异母姑姑、同父异母侄女和同父异母侄子。ACMG 表示美国医学遗传学会;Htx,心脏移植;LVAD,左心室辅助装置。
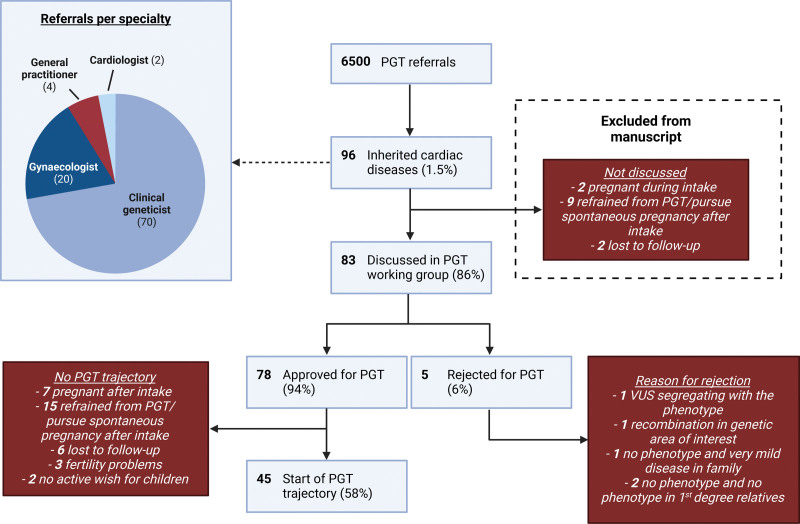
图 2:所有转诊进行植入前基因检测(PGT)的夫妇流程图。13对夫妇的指征未由PGT多学科团队讨论,因为在初步咨询后,这些夫妇决定不继续进行PGT。33个指征得到了PGT多学科团队的批准,但最终未启动PGT过程。VUS表示不明意义的变异。
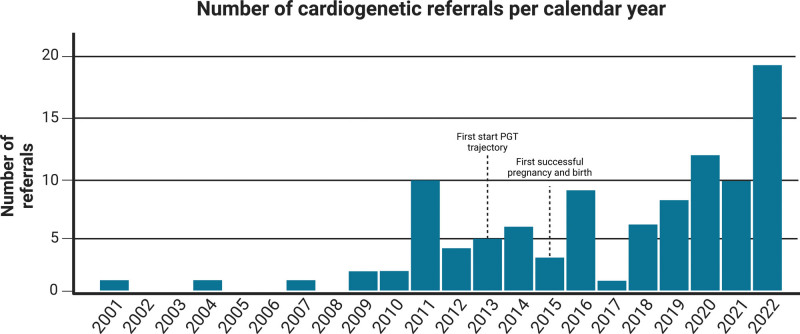
图 3:遗传性心脏病的植入前基因检测 (PGT) 转诊历史。尽管 PGT 自 1995 年起就已推出,但遗传性心脏病的首次 PGT 转诊是在 2001 年,但直到 2009 年才开始。此后,转诊数量急剧增加。ACM 表示心律失常性心肌病。
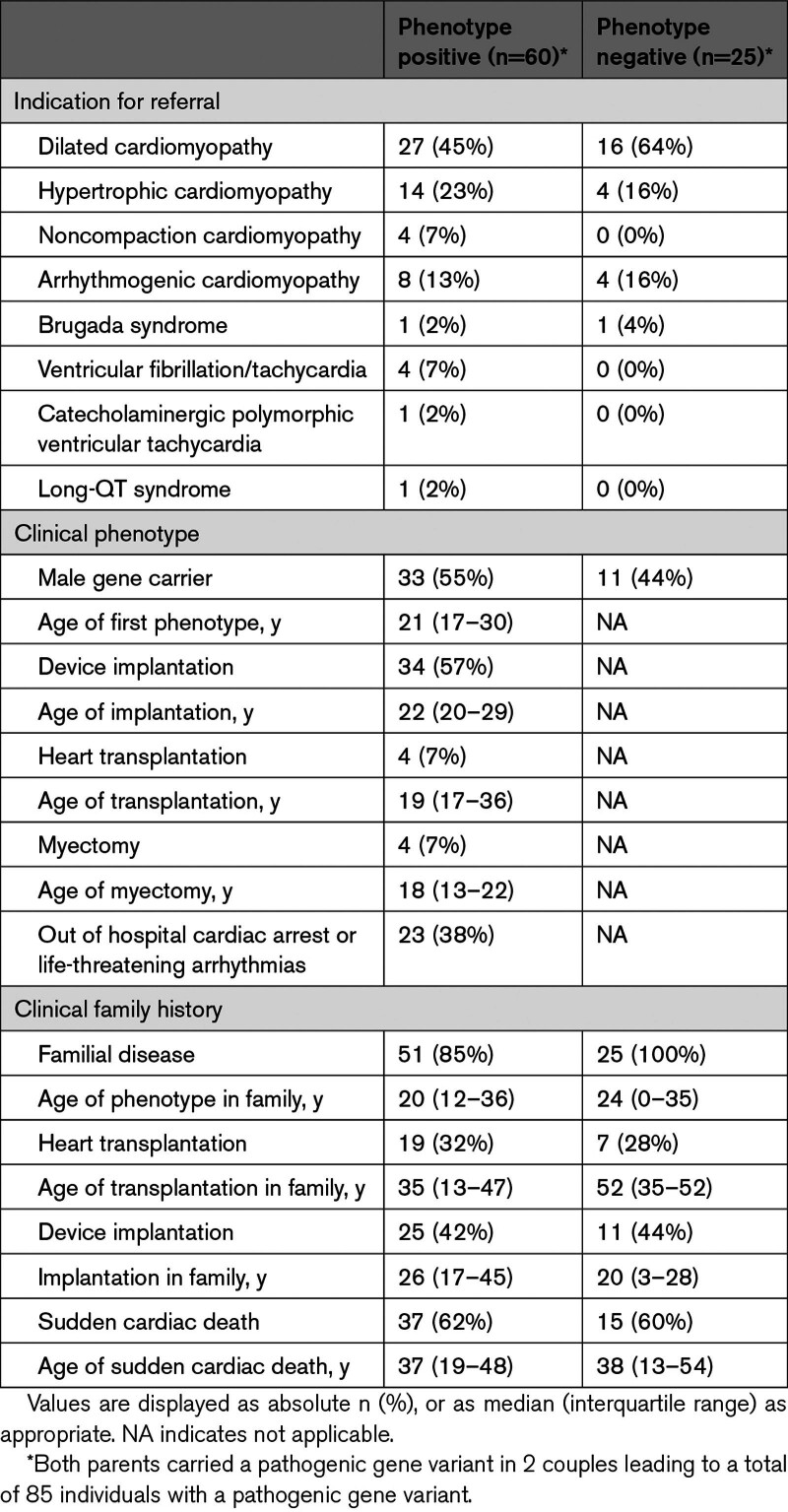
60 名指标患者 (70%) 具有心脏表型,表现年龄中位数为 21 岁(四分位距为 17-39 岁),其中 27 人为女性。具有表型的患者在年轻时接受心脏移植的几率很高 (7%),38% 的受影响基因携带者患有持续危及生命的心律失常,为此他们接受了来自设备多次适当的电击。9 名携带者没有家族性表现型。其他携带者均有家族史,特点是发病较早、心脏移植比例高、年轻时发生心脏性猝死的频率高(表2)。
表 2.所有接受植入前基因检测的基因携带者的基线特征 (n=85)
第二对夫妇涉及一位携带特发性室颤/室性心动过速风险DPP6单倍型的女性。然而,该家族谱系中发生了遗传重组,因此不确定该遗传区域对表型的贡献,并且家族内的变异分离情况不明确(图1;条件4)。剩余的81对夫妇可以在两步模型中得分(图5B)。
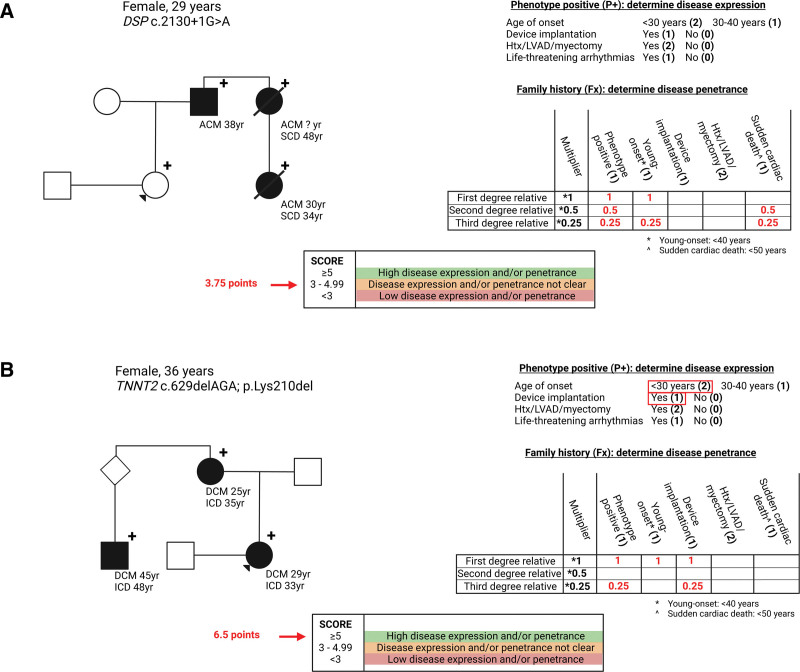
图 4:将模型第 2 步应用于纳入病例的两个示例。A,一名无症状的 29 岁女性,患有家族性DSP变异。由于她自己没有任何体征或症状,因此她在疾病表现上得分为 0 分。她的父亲、姑姑和堂兄都受到影响,并在表型、年轻发病和心源性猝死 (SCD) 上得分。总共得分 3.75 分,结论是疾病表现和渗透性尚不清楚。这主要是因为女性携带者申请 PGT 没有表型(尚未)。建议在多学科会议上讨论这个具体案例。B,一名 36 岁的女性,患有致病性TNNT2变异,在 29 岁时患上 DCM,为此她植入了
ICD。由于发病年龄较小且植入了设备,疾病表现得分为 3 分。一位姑姑和一位表亲都患有相同的变异和 DCM,因此接受了
ICD。疾病外显率总计 3.5 分,总分为 6.5 分。TNNT2 变异的疾病表达和外显率足够高,因此 PGT
估计的风险降低将足够。黑色符号表示受影响的个体。+ 符号表示存在家族变异。箭头表示个人请求 PGT。ACM
表示心律失常性心肌病;DSP,桥粒斑蛋白;Htx,心脏移植;ICD,植入式心律转复除颤器;LVAD,左心室辅助装置。
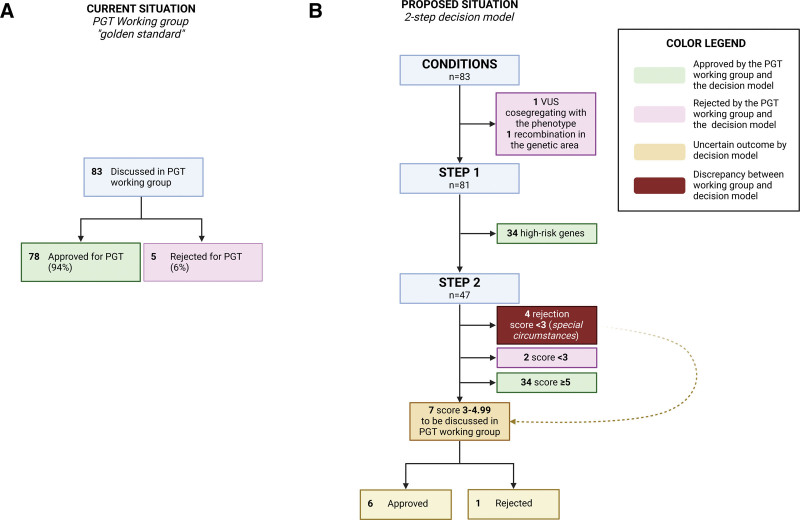
图 5:植入前遗传学检测 (PGT) 多学科团队的决策与佳学基因检测的决策模型的比较。在目前情况下,所有心脏疾病的 PGT 适应症均由 PGT 多学科团队讨论(A)。使用决策模型,只有 7 种适应症需要在 PGT 多学科团队中进一步讨论(B)。对于其他 76 对夫妇,该模型与 72 例 PGT 多学科团队的决策一致(敏感性为 95%)。
B)。
在步骤 1 中,模型显示所有高风险基因携带者的批准与 PGT MT 的决定完全一致。在步骤 2 中,34/47 (72%) 对夫妇得分高于 5,符合 PGT MT 的决定,有资格接受 PGT。
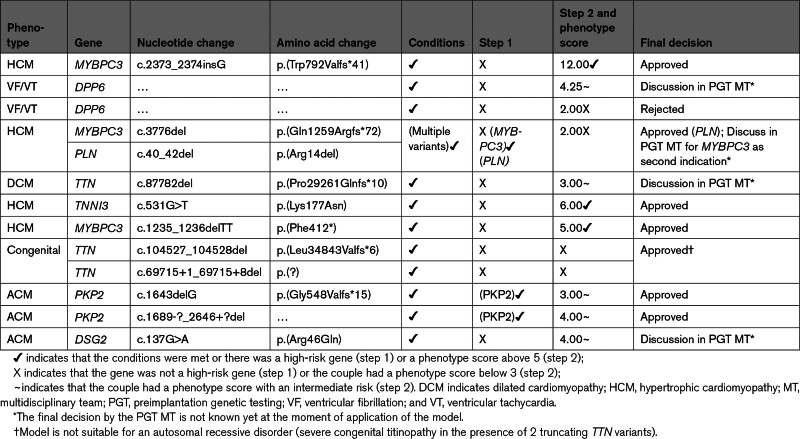
六对夫妇在模型中得分较低,仅基于该模型得出的结论是他们不适合进行 PGT。两对得分较低(<3)的夫妇也因为类似的原因被 MT 拒绝。另外 4 对被拒绝的夫妇得到了 PGT MT 的批准。这 4 对夫妇中的 3 对在第 2 步中得分较低(0.99、1 和 1.5),但他们主要都是因为非心脏基因中的不同致病变异而被转诊的,而 PGT 是这些基因的明确指征:BMPR2、AMER1和BRCA1。在所有情况下,PGT MT 都批准将心脏遗传变异作为次要指征添加,尽管心脏指征可能不会被批准作为单一指征。当前模型和 PGT MT 之间的另一个差异涉及一对夫妇,他们使用来自匿名捐赠者的捐赠精液进行体外受精,并且病史复杂。另一对使用同一捐献者精液的夫妇也生下了患有先天性 DCM 的儿童。患病儿童和精子捐献者的基因检测均显示致病的MYH7变异。由于缺乏捐献者的临床信息,因此评分仍为 2。总体而言,模型的 76 个决策中有 72 个与 PGT MT 的决策一致(95%)。模型与 MT 之间的差异都是由于基因检测结果特殊且复杂或家庭情况造成的。总结了 PGT MT 做出的所有单基因适应症及其相应的决策。值得注意的是,MT 对具有相同变异的不同夫妇做出了不同的决策(例如,DSPp.[Arg941*]),这表明不同变异之间的渗透率存在差异,需要有一个客观的模型来评分渗透率。
)。PLN变异(c.40_42del)是一种高风险变异,已获批准,但PGT MT
评估了添加MYBPC3作为第二种适应症。两对患有致病性PKP2变异的夫妇得分中等,但由于与PKP2
相关的高风险和渗透性而获得批准。一对夫妇都是截短型TTN变异的携带者,没有表现型,他们生下的第一个孩子也遗传了这两种变异,并死于严重的先天性心脏病。该模型不适用于常染色体隐性遗传疾病,但该适应症已获得
PGT MT 的批准。该决策模型的前瞻性应用表明,它在临床实践中的实用性很高,并为辅助决策提供了可量化的论据。
值得注意的是,佳学基因检测队列中的患者的临床表型与普通的遗传性心脏病患者相比更为严重。疾病发病的平均年龄为 21 岁,而普通遗传性心肌病队列的平均发病年龄为 52 岁。此外,在这个年龄组中,心脏移植(7%)、设备植入(57%)和危及生命的心律失常(38%)的比例非常高。这一发现表明,对严重受影响的夫妇存在转诊偏见。此外,夫妇在转诊前的自我选择可能发挥了一定作用,这意味着只有患有严重疾病的夫妇才会主动要求 PGT 等生殖选择。转诊偏见可能解释了该模型对预测 MT 决策的高敏感性,因为由于其他考虑而通过 MT 改善的受影响较轻的夫妇的代表性不足。
随着证据的增加和对基因型-表型相关性的进一步了解,高风险基因列表可能会随着时间的推移而扩大和编辑。高风险基因列表应被视为一个动态列表,其中建议的 6 个基因是第一个提议。该列表甚至可以进一步指定,包括特定变体和变体类型(例如,截短与错义)。未来测量心脏病多基因风险评分的可能性可以为评估家族中 PGT 的潜在风险降低提供更多信息。特别是由于某个基因中已获批准的变体并不能保证该特定变体也会在其他家族(甚至在家族内)中获批准,因为不同家族之间的渗透率可能有所不同。未来的遗传阻断基因检测需要将个体的多基因风险评分整合到模型中。此外,随着对基因特异性渗透率的一般知识正在迅速扩展,这些公共数据可以整合到模型中,以进一步微调家族内估计的渗透率。
所描述的针对不完全渗透性和 PGT 基因变异的方法将来也可以利用其他疾病特定的临床变量转化为其他遗传疾病。
PGT 过程对女性身体和夫妇心理均带来显著负担,同时该程序成本高昂,且整个流程可能需耗时数月。即便如此,并非所有 PGT 受试者都能成功怀孕并顺利生育健康婴儿,成功率约为 50%–60%。因此,夫妇在接受 PGT 之前,需充分了解该程序的费用、成功率、周期持续时间以及 IVF 过程,并接受必要的咨询服务。
PGT 在遗传性心脏病中的应用挑战
PGT 最初的设计目的是预防具有高渗透性的严重遗传病,通常在幼年即发病。然而,遗传性心肌病和心律失常多表现为成人发病,具有可变的表达模式和不完全的渗透性。大多数遗传性心脏病为常染色体显性遗传,因此子代有 50% 的概率遗传该变异。准确表征家族中的致病变异及其临床表型,对评估遗传变异的因果关系、疾病严重程度,以及筛选真正高风险的夫妇至关重要。不应对渗透率低或表达模式可变的遗传变异进行不必要的 PGT,以避免年轻夫妇经历长期的医疗过程、额外的负担和经济压力,特别是当 PGT 对其子代风险降低幅度较小或不确定时。
伦理、法规与可及性
不同国家在 PGT 的可行性、实施策略、伦理道德观及法律法规方面存在显著差异。同时,夫妇基于自身及家族经历对遗传性心脏病的严重程度认知也各不相同。由于缺乏全球统一政策或共同指南,以及各国或地方的不同立场,可能导致患有遗传性心脏病的夫妇在 PGT 的可及性和经济负担方面存在不平等现象。然而,整体趋势显示 PGT 需求不断增长,其在遗传性心脏病中的应用范围也在持续扩大。基于临床和遗传变量的客观决策模型,可帮助临床医生在与患者讨论 PGT 预期降低的风险时提供科学依据,从而改善 PGT 的可及性。美国(美国心脏病学会 [ACC]、美国心脏协会 [AHA])及欧洲(欧洲心脏病学会 [ESC]、欧洲心律协会 [EHRA])的最新指南已将 PGT 作为育龄期单基因遗传性心脏病患者的可选方案,并承认目前尚缺乏专门针对心脏遗传适应症的 PGT 指南。
本遗传阻断基因检测概述
本遗传阻断基因检测回顾性分析了过去 25 年间转诊至国家 PGT 中心的遗传性心脏病夫妇的临床数据,并旨在验证一种新型决策模型。该模型基于最新发表的心脏病风险预测模型及基因管理文献,可用于评估家族中遗传变异的渗透性,以及 PGT 在遗传性心脏病患者中的适用性(见图 1)。这一模型可为临床医生提供决策支持,帮助他们在咨询希望生育的遗传性心脏病患者时提供更精准的建议。
图 1:两步决策模型用于评估遗传性心脏病的植入前基因检测 (PGT) 转诊。有关条件和 2 个步骤的详细描述,请参阅方法部分。步骤 2 中临床参数后面的粗体数字表示可得的分数(参见图4中的 2 个模型应用示例)。一级亲属(50% 共享 DNA)是个人的父母、同胞兄弟姐妹或孩子。二级亲属(25% 共享 DNA)是叔叔、阿姨、侄子、侄女、祖父母、孙子女、同父异母兄弟姐妹和表兄弟姐妹。三级亲属(12.5% 共享 DNA)包括曾祖父母、曾孙子女、叔祖父、姑祖母、堂兄弟姐妹、同父异母叔叔、同父异母姑姑、同父异母侄女和同父异母侄子。ACMG 表示美国医学遗传学会;Htx,心脏移植;LVAD,左心室辅助装置。
接受 PGT 治疗的患者人群
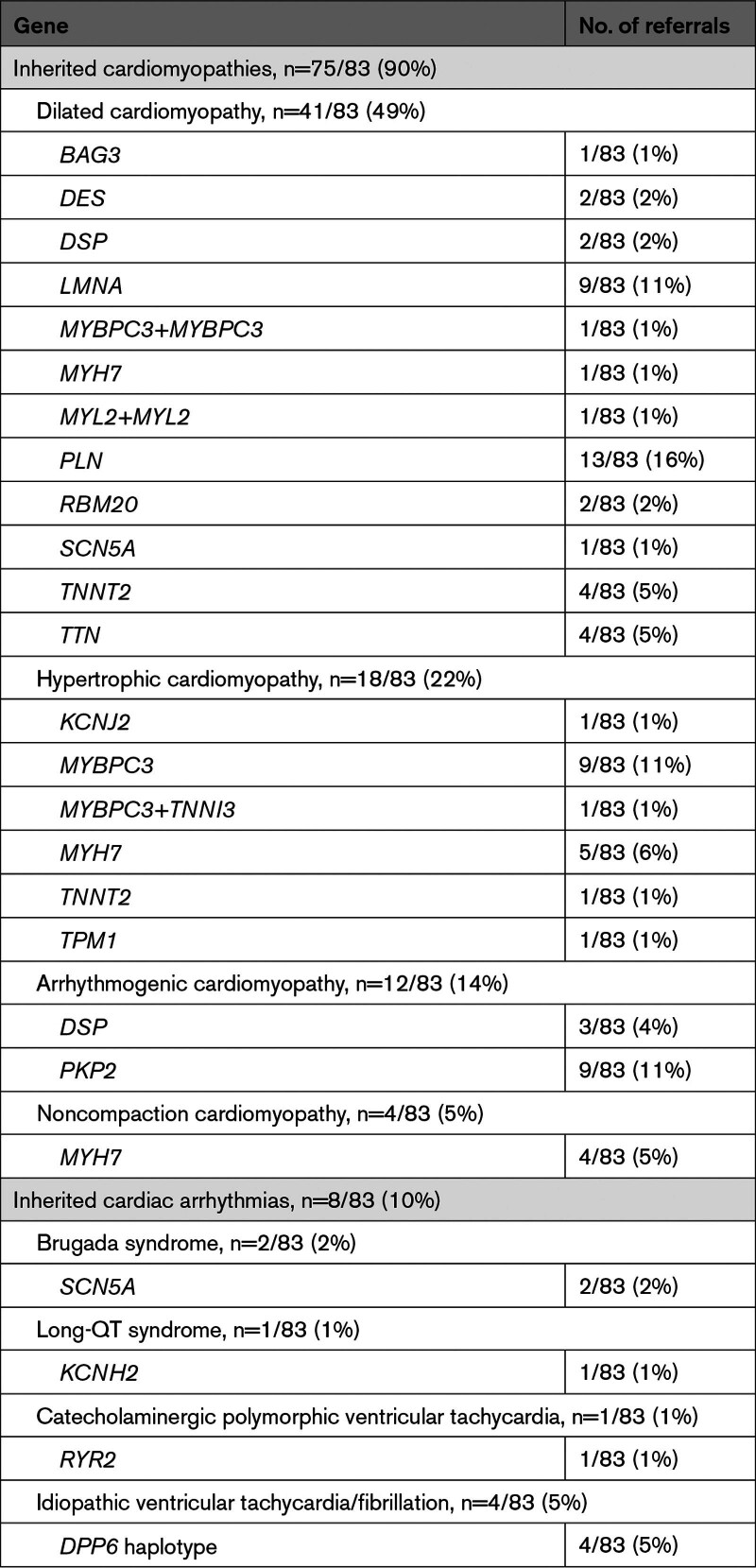
自 2001 年首次因遗传性心脏病转诊进行 PGT 以来,共有 96 对夫妇被转诊,占 PGT 总转诊数的 1.5%,其中过去 3 年内心脏遗传学转诊数的 43%(图2)。遗传性心脏病的 PGT 仅从 2009 年开始才有可能,从那时起,转诊数量已增加到 PGT 总转诊数的约 3.6%(图3)。大多数夫妇都是由临床遗传学家转诊到佳学基因检测中心的。96 对夫妇中有 13 对由于各种原因在入院咨询后没有继续进行 PGT(图2),因此进一步被排除在遗传阻断基因检测之外。总体而言,该队列由 83 对夫妇组成,他们在 19 种不同基因中存在致病遗传变异,从而导致 8 种不同的心脏表型:扩张型、肥厚型、致心律失常性和心肌致密化不全型心肌病、长 QT 综合征、布鲁格达综合征、儿茶酚胺能多形性室性心动过速和特发性室性心动过速/颤动(表1)。
图 2:所有转诊进行植入前基因检测(PGT)的夫妇流程图。13对夫妇的指征未由PGT多学科团队讨论,因为在初步咨询后,这些夫妇决定不继续进行PGT。33个指征得到了PGT多学科团队的批准,但最终未启动PGT过程。VUS表示不明意义的变异。

图 3:遗传性心脏病的植入前基因检测 (PGT) 转诊历史。尽管 PGT 自 1995 年起就已推出,但遗传性心脏病的首次 PGT 转诊是在 2001 年,但直到 2009 年才开始。此后,转诊数量急剧增加。ACM 表示心律失常性心肌病。
表 1.心脏疾病植入前基因检测转诊的表型和相应的遗传图谱

60 名指标患者 (70%) 具有心脏表型,表现年龄中位数为 21 岁(四分位距为 17-39 岁),其中 27 人为女性。具有表型的患者在年轻时接受心脏移植的几率很高 (7%),38% 的受影响基因携带者患有持续危及生命的心律失常,为此他们接受了来自设备多次适当的电击。9 名携带者没有家族性表现型。其他携带者均有家族史,特点是发病较早、心脏移植比例高、年轻时发生心脏性猝死的频率高(表2)。
表 2.所有接受植入前基因检测的基因携带者的基线特征 (n=85) *

决策模型的应用
该决策模型(图1)被回顾性地应用于83对夫妇,并通过2个具体案例(图4)进行了说明。4个预定义条件适用于81对夫妇(图5B)。对于1对未满足条件的夫妇,2个基因的家族变异分离情况较为复杂(条件4)。这位男性为轻度扩张型心肌病(DCM)患者,携带致病的截短TTN变异,同时在TNNC1基因中携带一个不明意义的变异(VUS)。他的兄弟携带这两个变异,患有严重的扩张型心肌病,需要在年轻时进行心脏移植。所有其他仅携带TNNC1基因VUS的亲属,均只有轻度的扩张型心肌病表型,而携带致病TTN变异的亲属则没有表型。目前尚不清楚VUS对该家族疾病表现和表型渗透率的影响。因此,未满足变异与表型分离的条件(图1;条件4)。此外,VUS的PGT是不允许的。第二对夫妇涉及一位携带特发性室颤/室性心动过速风险DPP6单倍型的女性。然而,该家族谱系中发生了遗传重组,因此不确定该遗传区域对表型的贡献,并且家族内的变异分离情况不明确(图1;条件4)。剩余的81对夫妇可以在两步模型中得分(图5B)。

图 4:将模型第 2 步应用于纳入病例的两个示例。A,一名无症状的 29 岁女性,患有家族性DSP变异。由于她自己没有任何体征或症状,因此她在疾病表现上得分为 0 分。她的父亲、姑姑和堂兄都受到影响,并在表型、年轻发病和心源性猝死 (SCD) 上得分。总共得分 3.75 分,结论是疾病表现和渗透性尚不清楚。这主要是因为女性携带者申请 PGT 没有表型(尚未)。建议在多学科会议上讨论这个具体案例。B

图 5:植入前遗传学检测 (PGT) 多学科团队的决策与佳学基因检测的决策模型的比较。在目前情况下,所有心脏疾病的 PGT 适应症均由 PGT 多学科团队讨论(A)。使用决策模型,只有 7 种适应症需要在 PGT 多学科团队中进一步讨论(B)。对于其他 76 对夫妇,该模型与 72 例 PGT 多学科团队的决策一致(敏感性为 95%)。
步骤 1(基因型)
34 对夫妇(42%)在以下确定的高危基因之一中存在致病变异:PLN(n=13)、LMNA(n=9)、RBM20(n=2)、BAG3(n=1)和PKP2(n=9),因此有资格进行 PGT。第 2 步(表型)
计算了其余 47 对夫妇的表现型评分。其中,34 对得分为 5 分或更高(72%),7 对得分在 3 分至 4.99 分之间(15%),6 对得分低于 3 分(13%)(图5模型与 PGT 多学科团队结果的比较
将决策模型的结果与PGT多学科团队(MT;图5)的决策进行了比较。如上文所述,2对不符合PGT条件的夫妇也因类似原因被MT拒绝。在步骤 1 中,模型显示所有高风险基因携带者的批准与 PGT MT 的决定完全一致。在步骤 2 中,34/47 (72%) 对夫妇得分高于 5,符合 PGT MT 的决定,有资格接受 PGT。
六对夫妇在模型中得分较低,仅基于该模型得出的结论是他们不适合进行 PGT。两对得分较低(<3)的夫妇也因为类似的原因被 MT 拒绝。另外 4 对被拒绝的夫妇得到了 PGT MT 的批准。这 4 对夫妇中的 3 对在第 2 步中得分较低(0.99、1 和 1.5),但他们主要都是因为非心脏基因中的不同致病变异而被转诊的,而 PGT 是这些基因的明确指征:BMPR2、AMER1和BRCA1。在所有情况下,PGT MT 都批准将心脏遗传变异作为次要指征添加,尽管心脏指征可能不会被批准作为单一指征。当前模型和 PGT MT 之间的另一个差异涉及一对夫妇,他们使用来自匿名捐赠者的捐赠精液进行体外受精,并且病史复杂。另一对使用同一捐献者精液的夫妇也生下了患有先天性 DCM 的儿童。患病儿童和精子捐献者的基因检测均显示致病的MYH7变异。由于缺乏捐献者的临床信息,因此评分仍为 2。总体而言,模型的 76 个决策中有 72 个与 PGT MT 的决策一致(95%)。模型与 MT 之间的差异都是由于基因检测结果特殊且复杂或家庭情况造成的。总结了 PGT MT 做出的所有单基因适应症及其相应的决策。值得注意的是,MT 对具有相同变异的不同夫妇做出了不同的决策(例如,DSP
决策模型的前瞻性应用
为了测试决策模型的临床实用性,佳学基因检测在 PGT MT 中讨论之前,将该模型前瞻性地应用于自 2022 年 7 月以来的所有新转诊。总共有 11 个新转诊(表3)。按照决策模型,3 对夫妇得分高,将获得批准,1 对夫妇得分低,在没有其他可能改变决策的非表型因素的情况下被拒绝。三对夫妇在第 2 步中得分中等,并在 PGT MT 中详细讨论了这些分数。另一对夫妇有 2 个致病变异(MYBPC3和PLN表 3:自 2022 年 7 月起对新转诊的决策模型的应用

佳学基因对遗传阻断方法的看法
佳学基因检测从经验丰富的国家转诊 PGT 中心概述了遗传性心脏病的 PGT,佳学基因检测观察到遗传性心脏病的 PGT 转诊数量急剧增加。佳学基因检测开发了一个两步决策模型来估计后代遗传性心脏病的疾病渗透率和表现,该模型具有高灵敏度(95%)和强大的临床决策效用,从而评估 PGT 的资格。该决策模型提供了一种透明、统一的方法来评估 PGT 转诊并为后代选择患病风险高的夫妇。该模型应始终与个体夫妇的个人背景相结合,从而将客观模型与夫妇的个人观点相结合。它可以在未来关于患有遗传性心脏病(如遗传性心肌病和心律失常)的夫妇的 PGT 纳入指南中实施。遗传性心脏病需要PGT指导
尽管过去几年的转诊数量很少,但可以预见,未来几年遗传性心脏病的 PGT 转诊数量将继续增加,这凸显了制定具体指导方针和政策的必要性。心脏疾病通常发病较晚,表型和遗传因素各异,这使得判断哪些夫妇的后代真正面临严重影响的风险变得复杂。越来越多的证据表明,大多数心脏疾病都是寡基因或多基因的。由于PGT旨在降低后代的高风险,因此对所有请求的 PGT 批准并不那么明显,因为在单个致病变异渗透率较低的家庭中,PGT 轨迹可能会导致高残留风险。佳学基因检测开发了一个强大且易于使用的包容模型,该模型可确定哪些夫妇的风险降低程度最高,从而为他们及其医生提供快速明确的决定,是否继续进行 PGT,同时优化这种专门程序的成本效益效率,并避免不必要的治疗。心脏疾病基因检测的临床意义
目前,发现致病基因变异主要影响患者的家庭,因为它将为有风险的家庭成员进行基因和心脏筛查。因此,对家庭成员进行基因检测还可以识别出可以选择PGT的年轻(无症状)亲属。美国心脏病学会和 AHA 的最新指南还强调了基因变异对携带者(包括患者及其家庭成员)生殖选择的影响。在发现(可能的)致病变异后,应讨论 PGT 等生殖选择,为所有患者及其亲属提供平等机会。患者和医学专家对生殖可能性的认识是提高所有患者获得 PGT 机会的第一步。值得注意的是,佳学基因检测队列中的患者的临床表型与普通的遗传性心脏病患者相比更为严重。疾病发病的平均年龄为 21 岁,而普通遗传性心肌病队列的平均发病年龄为 52 岁。此外,在这个年龄组中,心脏移植(7%)、设备植入(57%)和危及生命的心律失常(38%)的比例非常高。这一发现表明,对严重受影响的夫妇存在转诊偏见。此外,夫妇在转诊前的自我选择可能发挥了一定作用,这意味着只有患有严重疾病的夫妇才会主动要求 PGT 等生殖选择。转诊偏见可能解释了该模型对预测 MT 决策的高敏感性,因为由于其他考虑而通过 MT 改善的受影响较轻的夫妇的代表性不足。
遗传性心脏病 PGT 的未来实施和政策
佳学基因检测承认,不同国家和大洲的 PGT 政策和可及性各不相同。心脏病学和临床遗传学中的几乎所有程序都已得到很好的规范化,诊断和治疗指南也会根据最新文献定期更新。相比之下,关于遗传性心脏病的 PGT 文献却很少。作为国家PGT 中心,佳学基因检测的经验和提出的决策模型对于设计有关 PGT 的指南非常有价值。尽管佳学基因检测在日常实践中展示了决策模型的临床效用,但仍需要在外部国际队列中进行验证。此外,还应解决几个悬而未决的问题,例如,如何针对多种适应症实施决策。佳学基因检测描述了多对夫妇请求针对 >1 种适应症、复杂的基因检测结果或复杂的家庭情况进行 PGT。佳学基因检测得出结论,在所有这些情况下,仍应应用决策模型(即,在 2 种常染色体显性(心脏遗传)适应症的情况下,分别针对两种适应症),但佳学基因检测也建议在多学科团队中讨论这些复杂病例。此外,该模型可能会低估小家族中遗传变异分离的可能性有限的风险。在这种情况下,也可以考虑在 MT 中进行讨论。随着证据的增加和对基因型-表型相关性的进一步了解,高风险基因列表可能会随着时间的推移而扩大和编辑。高风险基因列表应被视为一个动态列表,其中建议的 6 个基因是第一个提议。该列表甚至可以进一步指定,包括特定变体和变体类型(例如,截短与错义)。未来测量心脏病多基因风险评分的可能性可以为评估家族中 PGT 的潜在风险降低提供更多信息。特别是由于某个基因中已获批准的变体并不能保证该特定变体也会在其他家族(甚至在家族内)中获批准,因为不同家族之间的渗透率可能有所不同。未来的遗传阻断基因检测需要将个体的多基因风险评分整合到模型中。此外,随着对基因特异性渗透率的一般知识正在迅速扩展,这些公共数据可以整合到模型中,以进一步微调家族内估计的渗透率。
所描述的针对不完全渗透性和 PGT 基因变异的方法将来也可以利用其他疾病特定的临床变量转化为其他遗传疾病。
留言板
下载客户端体验更佳,还能发布图片和表情~
亿万博主正在被热评!
999+
给此博文留言吧! 有机会上热评榜! 攒金币兑换礼品!


